设NA表示阿伏加德罗常数,下列叙述正确的
是 ( )
| A.71 g氯气被还原得到的电子数为2NA |
| B.100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA |
| C.标准状况下,2.24 L苯中含有的碳原子数为0.6 NA |
| D.用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼,当阴极析出64 g金属时阳极失去的电子数小于2NA |
实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4石蕊:5.0~8.0酚酞:8.2~10.0
用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
| A.溶液呈中性,可选用甲基橙或酚酞作指示剂 |
| B.溶液呈中性,只能选用石蕊作指示剂 |
| C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 |
| D.溶液呈碱性,只能选用酚酞作指示剂 |
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是
①热纯碱溶液洗涤油污的能力强②误将钡盐〔BaCl2、Ba(NO3)2〕当作食盐混用后,常用0.5%的Na2SO4溶液解毒③溶洞、珊瑚的形成④碳酸钡不能做“钡餐”而硫酸钡则能⑤泡沫灭火器灭火的原理
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
| A.33% | B.40% | C.50% | D.65% |
在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是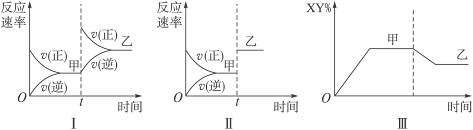
| A.图Ⅰ是加入适当催化剂的变化情况 |
| B.图Ⅱ是扩大容器体积的变化情况 |
| C.图Ⅲ是增大压强的变化情况 |
| D.图Ⅲ是升高温度的变化情况 |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol·(L·s) -1 |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| C.若升高温度Y的转化率减小,则正反应为吸热反应 |
| D.达到平衡时,X与Y 的浓度相等 |