常温下,下列溶液中一定能大量共存的离子组是
| A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32- |
| B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+ |
| C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+ |
| D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+ |
某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是( )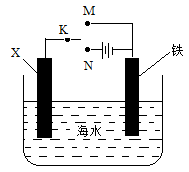
| A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 |
| B.若X为碳棒,开关K置于M处,会加快铁的腐蚀 |
| C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 |
| D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-=Fe3+ |
下列说法不正确的是()
A.已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+ O2(g)=H2O(g),△H="-285.8" kJ/mol O2(g)=H2O(g),△H="-285.8" kJ/mol |
| B.中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 |
| C.稀氨水中部分粒子的浓度大小关系:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+) |
| D.1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)=c(Y-)+c(HY),则HX为强酸 |
已知水的电离平衡曲线如图所示,下列说法正确的是()
A.水的离子积常数关系为:Kw(B)>Kw(A)>Kw(C)>Kw(D)
B.保持温度不变,向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH="7"
D.温度升高可实现由C点到D点
氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq) Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
| A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq) △H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.A点与B点相比,A点的c(Fe3+)大 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是()
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是()
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变