下表列出了前20号元素中的某些元素性质的有关数据:
| |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径(10—10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
— |
| 最低价态 |
— |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 、 (写两种分子的分子式)。某元素R的原子半径为1.02×10—10m,该元素在周期表中的位置是 ;电解⑧和R的某种熔融化合物时,当阴极消耗 2 mol 该化合物的正离子时,阳极可得3 mol单质,。由此可推断得知该盐的化学式是 (填化学式)。其阳极上所发生的电极方程式是:__________________________________。
某三原子分子(H2R)构成的气体,其摩尔质量为M g/mol,阿伏加德罗常数为NA,该气体质量为m g,则:
(1)该气体在标准状况下的体积为_______L;
(2)该气体在标准状况下的密度为 _______g/L;
(3)该气体所含原子总数为_______个;
(4)该气体的一个分子的质量为_______ g;
(5)该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度
为_______mol/L。
难溶于水的二硫化亚铁(FeS2)是黄铁矿的主要成分,它溶于稀硝酸的反应为:FeS2 +4HNO3="Fe(NO3)3+2S" + NO↑+2H2O
(1)将反应改写成离子反应方程式_________________________。
(2)用标出电子转移方向和数目:
FeS2 +4HNO3="Fe(NO3)3+2S" +NO↑+2H2O
(3)反应中氧化剂是_______;还原剂是_______。
(4)当反应中转移0.3mol电子,被还原的硝酸的物质的量为_______;可产生标态下NO气体的体积是_______L。
(18分)在下列物质中:
①Fe ②稀硫酸 ③醋酸 ④NaOH固体 ⑤FeCl3饱和溶液 ⑥Fe(OH)3胶体 ⑦蔗糖
(1)④NaOH固体属于_______________(填序号);⑥Fe(OH)3胶体属于_______________(填序号)。
A.纯净物 B.混合物 C.电解质 D.非电解质
(2)③醋酸与④NaOH在水溶液中反应的离子方程式为_______________。
(3)把①Fe投入②稀硫酸中发生反应的化学方程式为_______________;按照交叉分类法该反应属于_______________(填序号)。
A.氧化还原反应 B.离子反应 C.置换反应 D.复分解反应
(4)向⑥Fe(OH)3胶体中逐滴滴加⑥稀硫酸的过程中可观察到的现象是_______________
,发生反应的离子方程式为_______________。
(5)列举两种区别⑤FeCl3饱和溶液与⑥Fe(OH)3胶体的简单方法:_________________
氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为 (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G  N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为: 。
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为: (选填“A”或“B”),阴极反应式为: 。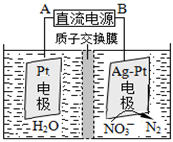
X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。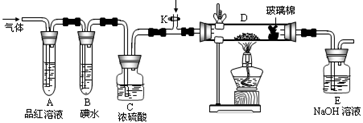
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
A氨水 B稀盐酸 C稀硝酸 D氯化钙 E双氧水 F硝酸银