有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO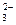 、SO
、SO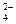 、AlO
、AlO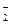 ,取该溶液进行以下实验:
,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除 的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除
存在。
(3)另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除 的存在。
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有 的存在,又可以排除
的存在。
(5)根据上述实验事实可以确定,该溶液中肯定存在的离子是 ,还不能确定是否存在的离子是 。
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
Ⅰ探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与(填装置编号)连接;装置C中的烧瓶内固体宜选用。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子。
Ⅱ探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为;F的烧杯所起的作用是。
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的胶管已经省略)。
(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为:
a→()()→()()→()()→ ()()(填仪器接口的字母编号)。连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通入氮气的主要目的是。
(2)装置E中观察到的主要实验现象有。
(3)装置C的作用是。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解生成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:。(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,同时生成NO,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:。
某化学小组设计如图实验装置
(1)若装置A中的固体药品为KClO3,则写出离子方程式。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是。
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是,。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象。(夹持装置略去)制备Cl2并探究氯气的相关性质:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明。
②称取Mg(NO3)2固体3.79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是;关闭K,用酒精灯加热时,正确操作是先然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3TiOSO4],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下:
请回答:
(1)步骤①中分离操作的名称是______;步骤⑥必须控制一定的真空度,原因是_________;
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2•xH2O)的化学方程式为__________;步骤④的离子方程式为_____________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因_______。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:_____Fe2++_____MnO4-+_____H+=_____Fe3++_____Mn2++_____
取步骤②所得晶体样品ag,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1KMnO4溶液20.00mL,则所得晶体中FeSO4•7H2O的质量分数为(以含a的式子表示)_____________________。