在指定溶液中,下列 各组离子能大量共存的是
各组离子能大量共存的是
A.pH=14的溶液:Na+、Ba2+、AlO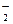 、ClO- 、ClO- |
B.加入Al放出H2的溶液:Cu2+、NH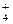 、Cl-、NO 、Cl-、NO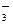 |
C.使紫色石蕊试液变蓝的溶液:K+、Fe3+、Cl-、NO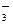 |
D.使甲基橙试液变红的溶液:Fe2+、Al3+、Cl-、NO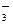 |
作为基本化学工业之一的氯碱工业,是通过电解饱和食盐水得到NaOH、Cl2和H2。有关电解产物的说法正确的是
| A.H2不能在C12中燃烧 | B.在阳极得到H2 |
| C.NaOH是弱碱 | D.Cl2可用于制造漂白粉 |
下列污水处理过程,不涉及化学变化的是
| A.加入明矾净水 | B.过滤水中的不溶物 |
| C.调节水的pH | D.沉淀水中的Cu2+离子 |
下列关于农药和肥料的说法正确的是
| A.氮肥只能通过人工合成而得到 |
| B.含磷化合物都可以作为磷肥直接使用 |
| C.草木灰含有K2CO3,可作为钾肥使用 |
| D.农药都对人体无害,可以大量使用农药 |
新型柴油发动机的受热面由耐高温且不易传热的材料制造。这种材料最可能是
A.陶瓷 B.不锈钢c.纯铁D.铝合金
下列做法体现环境保护理念的有
| A.将废旧电池扔入垃圾桶 | B.将实验室废液集中进行无害化处理 |
| C.将造纸厂的污水直接排放 | D.夏季将空调温度设置在26℃以上 |