有机化合物F是合成电子薄膜材料高聚物Z和增塑剂P的重要原料。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
① 3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、 “II”或“III”) 。
② X的结构简式是 。
③ l mol F在 中充分燃烧,生成
中充分燃烧,生成 和
和 的物质的量之比为8:3,消耗7.5mol
的物质的量之比为8:3,消耗7.5mol  ,其核磁共振氢谱中有3个吸收峰,且能与
,其核磁共振氢谱中有3个吸收峰,且能与 反应生成
反应生成 。
。
F分子中含有的含氧官能团的名称是 。
Y+F Z反应的化学方程式是 。
Z反应的化学方程式是 。 (
( 、
、 代表烃基或氢原子)
代表烃基或氢原子)
合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个 。
。
① A B反应的化学方程式是 。
B反应的化学方程式是 。
② B C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氯原子。C的结构简式是 。
C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氯原子。C的结构简式是 。
③ P的结构简式是 。
④符合下列条件的B的同分异构体共有(填数字) 种。
a.在酸性条件下水解为M和N b.一定条件下M可以转化为N
⑤已知: (R代表烃基或氢原子)
(R代表烃基或氢原子)
A的同系物W的相对分子质量为44。请参照示例写出以W和另一种有机物为原料合成肉桂醇(
 )的合成路线:
)的合成路线: 。
。


2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图: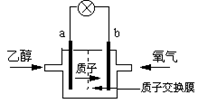
(1)_________极(填a或b)为电池的负极,电池工作时电流方向为______________;
(2)写出电池正极反应方程式___________________;
(3)电池工作时,1mol乙醇被氧化时就有________mol电子转移。
(1)选择适当的试剂除去下列物质中的少量杂质(括号内为杂质):
溴苯(溴):试剂______,反应方程式_________________________;
甲烷(乙烯):试剂______,反应方程式_________________________;
(2)选择合适的试剂鉴别下列物质:
苯和甲苯:试剂__________________________________;
乙烷和乙炔:试剂_____________________________________。
实验室用烧碱配制500 mL 0.32mol·L—1的NaOH溶液。
①需称量g的烧碱固体,固体应放在中置于天平左盘称量。
②配制过程中,不需要使用的仪器是(填符号)。
A.烧杯 B.量筒 C.玻璃棒 D.l000mL容量瓶 E.漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是(填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是:偏高的是:
A.称量时药品和砝码位置颠倒
B.称量时间过长
C.溶液未冷却即转入容量瓶
D.容量瓶洗净后未烘干
E.定容时俯视刻度线
F.定容后倒转摇匀,发现液面低于刻度线而未加水补充
某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题: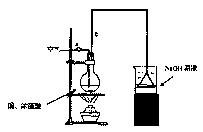
(1)烧杯中用NaOH溶液吸收的物质是:(填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的(填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应 后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行____、、后称量硫酸钡的质量为13.98g,请计算能与铜反
后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行____、、后称量硫酸钡的质量为13.98g,请计算能与铜反
应的硫酸的最低浓度是。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:,
。
现有短周期元素X形成的单质A与NaOH溶液反应,
有如下 转化关系:
转化关系: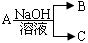 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为,实验室制备A的化学方程式为;
(2)若常温常压下,A为非金属固态单质 ,且其在电子工业中有着重要的用途,则工业制取A化学方程式为;
,且其在电子工业中有着重要的用途,则工业制取A化学方程式为;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
;其最高氧化物与NaOH溶液反应的离子方程式为;
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下: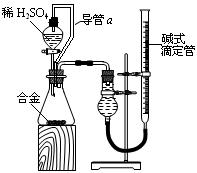
①装置中导管a的作用是 ;
;
②实验中准确测得4个数据:实验前该合金的质量m1 g,实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL;则通常状况时气体摩尔体积Vm=____________L·moL-1。