已知:可逆反应N:(g)+3H2(g)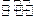 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是( )
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是( )
| A.达平衡时甲中N:的转化率为75% |
| B.达平衡时甲、乙中NH,的体积分数乙>甲 |
| C.达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 |
D.乙中反应的热化学方程式为2NH3(g)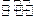 N2(g)+3H2(g)△H=+Q2kJ/mol N2(g)+3H2(g)△H=+Q2kJ/mol |
下列关于元素周期律的叙述正确的是
| A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 |
| B.元素的性质随着原子序数的递增而呈周期性变化 |
| C.随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 |
| D.主族元素原子的最高正价和负价的绝对值之和一定是8 |
元素性质呈现周期性变化的根本原因是
| A.原子半径呈周期性变化 |
| B.元素化合价呈周期性变化 |
| C.元素原子的核外电子排布呈周期性变化 |
| D.元素金属性或非金属性呈周期性变化 |
某元素的原子结构示意图为: ,则该元素在元素周期表中的位置是
,则该元素在元素周期表中的位置是
| A.第二周期,第ⅠA族 | B.第二周期,第ⅤA族 |
| C.第三周期,第ⅣA族 | D.第三周期,第ⅤA族 |
下列叙述中,正确的是
| A.在多电子的原子里,能量高的电子通常在离核近的区域内活动 |
| B.核外电子总是先排在能量低的电子层上,例如只有排满了L层后才排M层 |
| C.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| D.微粒的最外层只能是8个电子才稳定 |
下图是周期表中短周期的一部分。已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是
| A.原子半径的大小顺序是W>Y>Z |
| B.X的氢化物没有Z的氢化物稳定 |
| C.常见的Y的氢化物具有正四面体结构 |
| D.Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |