(16分)
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】 和KI反应的离子方程式为:
和KI反应的离子方程式为: (1)
(1)
平均反应速率的计算式为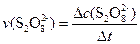 。
。
实验时,向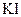 、
、 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应: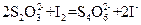 (2)
(2)
反应(1)生成的 立即与
立即与 反应,生成无色的
反应,生成无色的 和
和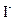 。
。 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
|
| 试剂 用量 (mL) |
0.20 mol·L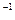 (NH4)2S2O8溶液 (NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
0.20 mol·L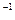 KI溶液 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
0.010 mol·L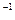 Na2S2O3溶液 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
| 0.2%淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
0.20 mol·L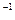 KNO3溶液 KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
0.20 mol·L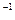 (NH4)2SO4溶液 (NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
20℃时,反应时间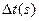 |
32 |
67 |
130 |
66 |
135 |
|
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是 。
(3)第①组实验的 mol·(L·s)
mol·(L·s)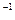 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可) 。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:


该小组根据上述原理设计如图19所示装置制备 。
。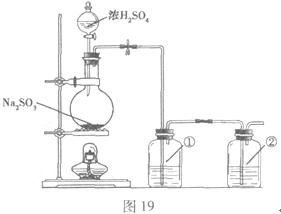
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是① ;② 。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是 。
(3)反应结束后,从制得的 稀溶液中得到
稀溶液中得到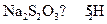 晶体的主要操作包括: 。
晶体的主要操作包括: 。
(10分)实验室要配制100 mL 0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是 ( )
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是__________________________。
(3)容量瓶上除有刻度线外还应标有__________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
(6分)如图为实验室分离水和乙醇的装置图,根据图示回答下列问题。

(1) 图中的两处明显的错误是:
_________________________________,
_________________________________。
(2) A仪器的名称是____________,B仪器 
的名称是_______________。
(3) 实验时向A中加入少量碎瓷片的作用是:
____________________________________________________。
(4)实验后锥形瓶中所收集到的物质为____________。
(6分)有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2SO4中的一种或几种,现按下列步骤进行实验:
(1) 将该粉末溶于水得无色溶液和白色沉淀。
(2) 在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3) 取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰。
由上述现象推断:该混合物中一定含有(填写化学式)______________________________;一定不含有_____________________;可能含有__________________________。
(10分)(1) 0.5 mol H2SO4的质量是_________g,含__________个分子,含_______mol氧原子,能和_________mol NaOH完全反应,该硫酸所含氢元素的质量与________mol H3PO4或_______ g HCl中所含氢元素的质量相同。
(2)含有相同氧原子数的CO和CO2,其质量比为;同温同压下的体积比为。
将2molH2O和2molCO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g) 2H2+O22CO+O2
2H2+O22CO+O2 2CO2
2CO2
(1)当上述体系达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是__________________和________________,或___________和__________(填它们的化学式)。
(2)若平衡时O2和CO2的物质的量分别为n (O2)平=a mol,n(CO2)平=b mol,试求n(H2O)平=__________(用含a、b的代数式表示)。