反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速率v=k(CH2)m(CCl2)n,式中k为常数,m、n值可用下表中数据确定。由此可推得的m、n值正确的是 
| CH2 (mol·L-1) |
CCl2 (mol·L-1) |
v(mol·L-1·s-1) |
| 1.0 |
1.0 |
1.0k |
| 2.0 |
1.0 |
2.0k |
| 2.0 |
4.0 |
4.0k |
| A.m=1,n=1 | B.m=1/2,n=1/2 |
| C.m=1/2,n=1 | D.m=1,n=1/2 |
用1L1.0mol·L-1NaOH溶液吸收0.8molCO2,所得溶液中CO32-和 HCO3-的物质的量之比是
HCO3-的物质的量之比是
| A.1∶3 | B.2∶1 | C.2∶3 | D.3∶2 |
某Al2(SO4 )3溶液V mL中含a g Al3+,取出V/4 mL溶液稀释成4V mL后,SO42-的物质的量浓度为
)3溶液V mL中含a g Al3+,取出V/4 mL溶液稀释成4V mL后,SO42-的物质的量浓度为
A.125/54V mol·L-1 mol·L-1 |
B.125a/36V mol·L-1 |
| C.125a/18V mol·L-1 | D.125a/V mol·L-1 |
在由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2-;②K+、Fe2+、I-、SO42-③Na+、Cl -、NO3-、SO42-
-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-⑤ K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
根据下列反应判断有关物质还原性由强到弱的 顺序是
顺序是
H2SO3+I2+H2O==2HI+H2SO4 2FeCl3+2HI==2FeCl2+2HCl+I2
3FeCl2+4HNO3==2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
C.Fe2+>I->H2SO3> NO NO |
D.NO>Fe2+>H2SO3>I- |
下列反应的离子方程式书写正确的是
| A.浓烧碱溶液中加入铝片:Al+2OH- = AlO2-+H2↑ |
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O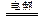 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ = 2Fe3++2H2O |
| D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O |