合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g) 2NH3(g),△H < 0
2NH3(g),△H < 0
673K,30MPa下n(NH3)和n(H2)随时间变化的关系
如下图所示。下列叙述正确的是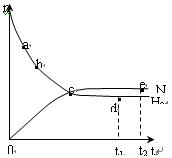
| A.点a的正反应速率比点b的大 |
| B.点 c处反应达到平衡 |
| C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 |
| D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值小 |
在下列有关晶体的叙述中错误的是
| A.稀有气体的原子能形成分子晶体 | B.离子晶体中,一定存在离子键 |
| C.原子晶体中,只存在共价键 | D.金属晶体的熔沸点均很高 |
CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用分别是
| A.分子间作用力,离子键 | B.化学键,分子间作用力 |
| C.化学键,化学键 | D.分子间作用力,分子间作用力 |
已知1/2H2(g)+1/2C12(g) HCl(g);△H=-92.3kJ·mol-1,则反应2HCl(g)
HCl(g);△H=-92.3kJ·mol-1,则反应2HCl(g) H2(g)+Cl2(g)的△H1为
H2(g)+Cl2(g)的△H1为
| A.+92.3 kJ·mol-1 | B.-92.3 kJ·mol-1 |
| C.-184.6 kJ·mol-1 | D.+184.6 kJ·mol-1 |
用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是
| A.不用稀硫酸改用98%的浓硫酸 | B.加热 |
| C.滴加CuSO4溶液 | D.不用铁片改用铁粉 |
一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2 + 3H2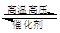 2NH3(正反应是放热反应)。下列有关说法正确的是
2NH3(正反应是放热反应)。下列有关说法正确的是
| A.达到化学反应限度时,可生成2mol NH3 |
| B.向容器中再加入N2,可以加快反应速率 |
| C.降低温度可以加快反应速率 |
| D.1mol N2和3mol H2的总能量低于2mol NH3的总能量 |