某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
| A.该溶液可能是由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO— ) 一定大于c(Na+ )、c(NH4+)之和 |
一定体积0.01 mol·L-1的稀硝酸恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01 mol·L-1 NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸的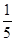 ,则样品中铁、铝的物质的量之比为( )。
,则样品中铁、铝的物质的量之比为( )。
| A.2∶3 | B.1∶3 | C.1∶4 | D.5∶3 |
已知HNO2在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。
| pH范围 |
>7 |
<7 |
| 产物 |
NO3- |
NO、N2O、N2中的一种 |
下列有关说法错误的是( )。
A.碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-=NO3-+Cl-
B.向冷的NaNO2溶液中通入CO2可得到HNO2
C.向冷的NaNO2溶液中加入稀硫酸可得到HNO2
D.向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色
有a、b、c、d、e五种气体,进行下列实验:
| (1)a和b混合 |
气体变红棕色 |
| (2)c和d混合 |
产生白烟 |
| (3)c和e分别通入少量溴水中 |
溴水都变成无色透明的液体 |
| (4)b和e分别通入氢硫酸中 |
都产生淡黄色浑浊 |
a、b、c、d、e依次可能是( )。
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2
D.HCl、CO2、NH3、H2S、CH4
NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列有关表述正确的是( )。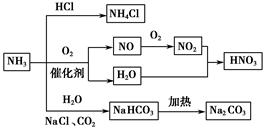
| A.NH4Cl和NaHCO3都是常用的化肥 |
| B.NH4Cl、HNO3和Na2CO3受热时都易分解 |
| C.NH3和NO2在一定条件下可发生氧化还原反应 |
| D.NH3合成NaHCO3的副产物的水溶液呈中性 |
某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升。下列说法错误的是( )。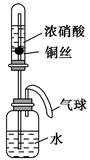
| A.实验过程中气球体积会发生变化 |
| B.广口瓶中液体的pH减小 |
| C.广口瓶中有化合反应发生 |
| D.试管中不可能发生分解反应 |