(东莞中学2008届第一次六校联考)常温下,下列溶液中一定能大量共存的离子组是
| A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32- |
| B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+ |
| C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+ |
| D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+ |
下述做法符合绿色化学的是()
| A.以煤等燃料作为主要生活燃料 |
| B.利用太阳能、风能和氢能等能源替代化石能源 |
| C.鼓励私人购买和使用汽车代替公交车 |
| D.限制使用电动车k |
由下列结构片段组成的蛋白质在胃液中水解,不可能产生的氨基酸是( )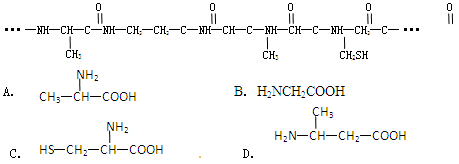
β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。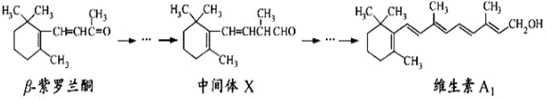
下列说法正确的是( )
| A.β—紫罗兰酮可使酸性KMnO4溶液褪色 |
| B.1mol中间体X最多能与2molH2发生加成反应 |
| C.维生素A1易溶于NaOH溶液 |
| D.β—紫罗兰酮与中间体X互为同分异构体 |
对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得,下列有关说法不正确的是( )
| A.上述反应的原子利用率可达到100% |
| B.上述反应的反应类型为加成反应 |
| C.在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰 |
| D.对羟基扁桃酸可以发生加成反应、取代反应和消去反应 |
白藜芦醇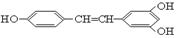 广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有搞癌性。能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有搞癌性。能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
| A.1mol 1mol | B.3.5mol 7mol |
| C.3.5mol 6mol | D.6mol 7mol |