分析下列各氧化还原反应中各元素化合价的升降情况,指出各反应的氧化剂、还原剂:
(1)Fe+CuSO4=FeSO4+Cu
(2)2H2O 2H2↑+O2↑
2H2↑+O2↑
(3)CO2+C 2CO
2CO
(4)2H2S+SO2=2H2O+3S↓
(5)3S+6KOH=2K2S+K2SO3+3H2O
下列实验现象的描述错误的是()
| A.氢气在氯气中燃烧生成绿色烟雾 |
| B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒 |
| C.向铜丝在氯气中燃烧后的集气瓶加入少量的水,所得溶液显绿色 |
| D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
“纳米材料”(1 nm=10-9 m)是指研究开发直径为几纳米至几十纳米的材料。如将“纳米材料”分散到某液体中,对于所得分散系的叙述不正确的是( )
| A.光速通过此分散系时会形成一条光亮的“通路” |
| B.此分散系中“纳米材料”的粒子在做不停的、无序的运动 |
| C.在外加电场作用下,“纳米材料”的粒子可能向电极做定向运动 |
| D.用滤纸过滤的方法可以从此分散系中分离得到该“纳米材料” |
下列判断正确的是( )
| A.仅用水能确定某Na2O粉末中是否含有Na2O2 |
| B.仅用CO2能确定某Na2O粉末中是否含有Na2O2 |
| C.可利用在空气中加热的方法除去Na2O中的Na2O2 |
| D.将足量的Na2O2、Na2O分别加到酚酞试液中,最终溶液均为红色 |
下列措施不能达到节能减排目的的是( )
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替白炽灯 |
将a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,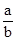 值可能为()
值可能为()
| A.0.5 | B.0.45 | C.0.85 | D.1.0 |