三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o它能水解,有关叙述正确的是 ( )
| A.氯化硼液态时能导电而固态时不导电 |
| B.氯化硼中心原子采取sp杂化 |
| C.氯化硼分子呈正三角形 |
| D.氯化硼分子是由极性键构成的极性分子 |
2011年9月12日,2011年度拉斯克奖的获奖名单揭晓,中国浙江籍科学家屠呦呦获得的临床医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命”。右图为青蒿素的结构简式。根据青蒿素的结构分析,从植物中提取青蒿素的方法合理的是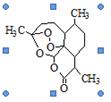
| A.用有机溶剂萃取后蒸馏(如乙醚等) |
| B.用冷水浸泡 |
| C.用热NaOH溶液浸泡 |
| D.高温灼烧 |
在刚性密闭容器中加入P、Q发生下列反应,P(g)+2Q(g)  2S(g)+R(s)下列说法可以说明反应已达平衡的是
2S(g)+R(s)下列说法可以说明反应已达平衡的是
| A.反应容器中压强不随时间变化而变化 |
| B.反应容器中P、Q、R、S四者共存 |
| C.P和R的生成速率相等 |
| D.反应容器中物质的总物质的量保持不变 |
下列对糖类叙述正确的是 ( )
A.都可以溶于水 B.都含有C、H、O元素
C.都符合通式Cn(H2O)m D.都有甜味
只用水就能鉴别的一组物质是
| A.苯 乙酸 乙醇 | B.乙醇 乙醛 乙酸 |
| C.苯 乙酸 四氯化碳 | D.苯 汽油 乙醇、 |
皂化反应的实质是
| A.油脂酸性水解 | B.油脂碱性水解 |
| C.糖类的碱性水解 | D.羧酸的酯化反应 |