下列实验的基本操作正确的是 ( )
| A.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 |
| B.在使用试纸测定某溶液的pH时,必须先用蒸馏水湿润,再将待测液滴到试纸上 |
| C.向某未知溶液中先加入过量稀盐酸,再加入BaCl2溶液,检验是否含SO42- |
| D.将一定量的水加入到10 mL 18 mol/L的浓硫酸中使溶液总体积变为100 mL,则稀释后的溶液的浓度为1.8 mol/L |
有X、Y、Z、M四种金属,已知:X可以从Y 的盐溶液中置换出Y;X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子,则这四种金属的活动性由强到弱的顺序是()
| A.X 〉Y〉Z〉M | B.X 〉Z〉M〉Y |
| C.M 〉Z〉X〉Y | D.X 〉Z〉Y〉M |
某原电池总反应离子方程式为:2Fe3+ +Fe ==3 Fe2+,能实现该反应的原电池是()
A正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
C正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是()
| A.I和III | B.I和IV | C.II和III |
D.II和IV |
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为()
| A.C + H2O ==CO + H2 ; ΔH==+131.3KJ·mol—1 |
| B.C(s)+ H2O(g) ==CO(g) + H2(g) ; ΔH==+10.94KJ·mol—1 |
| C.C(s)+ H2O(l) ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol—1 |
D.C(s)+ H2O(g)  ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol—1 ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol—1 |
在密闭容器进行如下反应:
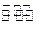
 已知X1、Y2、Z的起始浓
已知X1、Y2、Z的起始浓 度分别为
度分别为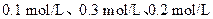 ,在一定条件下当反应达到平衡时,各物质的浓度有可能()
,在一定条件下当反应达到平衡时,各物质的浓度有可能()
A. |
B. |
C.  |
D. |