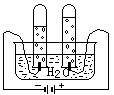
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是 ( )
| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH值变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲 = V乙 |
| D.电极反应式:甲中阴极:Cu2++2e- |
乙中负极:Mg-2e- Mg2+
人们会利用纳米级(1-100nm,1nm=10-9m)微粒物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用。将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中正确的是
| A.该分散系能发生丁达尔效应 |
| B.该分散系为溶液 |
| C.该分散系属于悬浊液 |
| D.该分散系放置一段时间可能很快出现分层现象 |
现有三组溶液:①汽油和氯化钠溶液② 39%的乙醇溶液③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次()
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
在标准状况下,0.56g某气体的体积为448mL,则该气体的相对分子质量为
| A.2 | B.28 | C.0.028 | D.56 |
下列叙述正确的是( )
| A.1 mol H2SO4的质量为98 g·mol-1 |
| B.H2SO4的摩尔质量为98 g |
| C.常温常压下,11.2LCO2所含分子数为0.5NA |
| D.6.02×1022个H2SO4分子的质量为9.8 g |
下列操作过程中一定有氧化还原反应发生的是()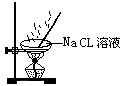
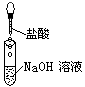
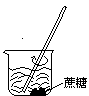
A. B. C. D.