下列事实不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅。 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 CO2(g)+NO(g),平衡体系增大压强可使颜色变深。 |
| C.升高温度能够增大Na2CO3溶液的PH。 |
| D.工业上合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施。 |
已知有反应BrO3-+5Br-+6H+===3Br2+3H2O。下列反应中从反应原理来看与该反应最相似的是
A.2KNO3 2KNO2+O2↑ 2KNO2+O2↑ |
B.NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| C.3NO2+H2O===2HNO3+NO |
| D.SO2+2H2S===3S↓+2H2O |
下列各项所述的关系正确的是
| A.有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 |
| B.一种物质被氧化,必然有另一种物质被还原 |
| C.被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 |
| D.氧化剂在反应中被氧化,还原剂在反应中被还原 |
甲、乙为单质,丙、丁为氧化物,它们存在如图转化关系。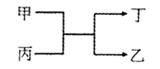
则甲和乙不可以是
| A.碳和硅 | B.镁和碳 | C.钠和氢气 | D.铝和铁 |
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。
下列说法正确的是
| A.Na2O2中阴阳离子数目之比为1∶1 |
| B.反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑ |
| C.反应③最多能转移0.1 mol电子 |
| D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③ |
下列实验现象预测或实验操作或实验原理正确的是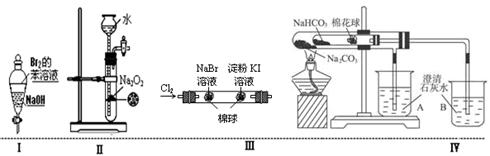
| A.实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明 |
| B.实验Ⅱ:可随关随停,随开随启控制氧气的发生 |
| C.实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性Cl2>Br2>I2 |
| D.实验Ⅳ:小试管中NaHCO3分解,B中石灰水变浑浊,说明稳定性Na2CO3>NaHCO3 |