下列对有关微粒结构的表示或说法不正确的是 ( )
| A.氮分子的电子式为::N:::N: |
| B.氨分子的空间构型为三角锥型,属于极性分子 |
| C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子 |
| D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同 |
下列事实不能用勒夏特列原理解释的是
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率; |
| B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率; |
| C.在实验室里,可用碳酸钙粉末和稀硫酸制得二氧化碳气体; |
| D.实验室用排饱和食盐水的方法收集氯气。 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
① Sn(s、白) + 2HCl(aq)= SnCl2(aq)+ H2(g)△H1
② Sn(s、灰) + 2HCl(aq)= SnCl2(aq)+ H2(g)△H2



|
③ Sn(s、灰) Sn(s、白)△H3=" +" 2.1kJ/mol
下列说法正确的是高温下,某反应达平衡,平衡常数K=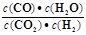 .恒容时,温度升高,H2浓度减小。下列说法正确的是
.恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应化学方程式为CO+H2O=CO2+H2 |
在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
 |
CO2 |
H2 |
CO |
H2O |
| 甲 |
amol |
amol |
0mol |
0mol |
| 乙 |
2amol |
amol |
0mol |
0mol |
| 丙 |
0mol |
0mol |
amol |
amol |
| 丁 |
amol |
0mol |
amol |
amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
一定温度下,可逆反应A2(s)+3B2(g) 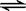 2AB3(g)达到平衡的标志是
2AB3(g)达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时消耗3mol B2 |
| C.混合气体总的物质的量 |
| D.密闭容器内的物质的质量不再改变 |