把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为 ( )
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
酶是蛋白质,因而具有蛋白质的特性,酶又是生物制造出来的催化剂,能在许多有机反应中发挥作用,以下表示温度t与反应速度v的关系曲线中,有酶参加的是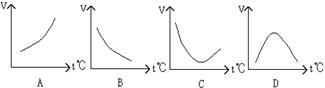
化学反应C(s)+H2O(g) 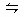 CO(g)+H2(g) ΔH>0达到平衡,下列叙述中正确的是 ( )
CO(g)+H2(g) ΔH>0达到平衡,下列叙述中正确的是 ( )
| A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.加入固体碳,平衡向正反应方向移动 |
| C.加入水蒸气使容器内压强增大,平衡向逆反应方向移动 |
| D.扩大容器容积,平衡向正反应方向移动 |
对于反应2A(g)+B(g) 2C(g)△H<0,下列图象正确的是()
2C(g)△H<0,下列图象正确的是()
一定温度下,在一定容的密闭容器中充入NO2发生如下反应:2NO2 N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将()
N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将()
| A.增大 | B.减小 | C.不变 | D.无法确定 |
下列说法中可以说明2HI(g)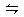 H2(g)+I2(g)已达到平衡状态的是()
H2(g)+I2(g)已达到平衡状态的是()
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化