[化学—选修有机化学基础] (15分)
中药莲花清瘟胶囊是治疗甲型H1N1流感的有效药物,连翘是其主要成分之一,芳香族化合物X是合成连翘的有效成分连翘酯苷的中间体。
已知:
①X的相对分子质量180,碳的质量分数为60%,氢为4.45%,其余为氧;
②1mol X最多能与3mol NaOH反应,且X能与NaHCO3反应产生CO2气体;
③X遇FeCl3发生显色反应;
④经红外光谱分析X分子中含有碳碳双键。
请回答下列问题:
(1)X的分子式为 ,X中含有的官能团的结构简式为 。
(2)X可发生的反应有 。
| A.取代反应 | B.加聚反应 | C.水解反应 | D.银镜反应 E.酯化反应 |
(3)X分子中苯环上两个相同的取代基相邻,与另一种取代基不相邻,核磁共振氢谱表明有8种氢原子,则其结构简式为 。
(4)X与足量的浓溴水反应的化学方程式为 。
(5)有机物Y与X互为同分异构体,请写出符合下列条件的Y结构简式 。
①Y的苯环上有三个互不相邻的取代基,遇FeCl3不发生显色反应,不与NaHCO3反应,但能与Na反应生成H2;
②1mol Y最多能与4mol Ag(NH3)2OH发生银镜反应;
③在一定条件下,1mol Y最多与2mol NaOH反应。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示:已知G在生产中可作为一种耐火材料,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素,其中I+B→A+G属于置换反应。(部分反应物、生成物没有列出)。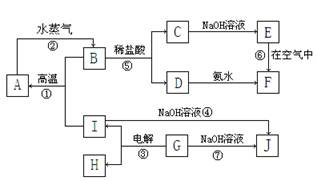
请 填写下列空白:
填写下列空白:
(1)如何检验D中阳离子:
(2)写出反应②的化学方程式:
写出反应⑦的离子方程式:
(3) E在空气中变成F的实验现象是
(4)写出反应⑥的化学方程式并用单线桥标出电子转移的方向和数目:
计算该反应中若转移2 mol电子,需要标况下的O2_________________L。
(1)34g NH3共有__________mol原子,0.1molH2S共约有_____个氢原子。同温同压下,等体积的NH3和H2S气体的质量比为_________,含有的分子数目之比为。等质量的NH 3和H2S中分子数目之比为_________。
3和H2S中分子数目之比为_________。
(2)在标准状况下,3 5.5g Cl2的体积约是_________L,将其与氢气完全化合生成氯化氢需氢气的物质的量是_________mol,将生成的氯化氢气体溶于1000 g水中,得到密度为a g·cm-3的盐酸,则该盐酸的物质的量浓度是_________ mol/L。
5.5g Cl2的体积约是_________L,将其与氢气完全化合生成氯化氢需氢气的物质的量是_________mol,将生成的氯化氢气体溶于1000 g水中,得到密度为a g·cm-3的盐酸,则该盐酸的物质的量浓度是_________ mol/L。
(3)欲配制500mL 0.2mol/L Na2CO3溶液,需要用天平称量Na2CO3·10H2O晶体质量为。若从配好的上述溶液中取出50mL于一试剂瓶中,需要给它贴上标签,标签上的内容是;若再从中取出10mL溶液加水稀释至20mL,则此溶液中Na+的物质的量浓度为。
(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液②20毫升0.50mol/L硫酸水溶液③30毫升0.40mol/LHCl溶液④40毫升0 .30mol/LCH3COOH水溶液⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是___________。
.30mol/LCH3COOH水溶液⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是___________。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为。
③已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是。
| A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.c(CO32-)=c(HCO3-)+c(H2CO3) |
②纯碱溶液呈碱性,其原因是(用离子方程式表示),
验证纯碱溶液呈碱性的实验方法(简述操作过程):。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示) 。
。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
在氯化铜(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下图所示的操作步骤进行提纯.已知在pH为4~5的环境中,Cu2+、Fe2+ 不生成沉淀,而Fe3+几乎完全沉淀
不生成沉淀,而Fe3+几乎完全沉淀
(1)为什么加入氧化剂X?________________
(2)下列物质都可以作为氧化剂,其中最适合于本实验的是
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
(3)物质Y是;沉淀E是。
某课外活动小组进行电解饱和食盐水的实验(如图)。请同答下列问题。
(1)通电一段时间后,可观察到_______________电极(填
“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电
极反应式为____________。
(2)该溶液电解反应的化学方程式为。
(3)若开始时改用铁棒做阳极,阳极的电极反应式为 ___________________________________。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如下图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。其中a是___极(填“正”或“负”),b极的电极反应式为。
(5)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是(填序号)
| A.该能量转化系统中的水也是可以循环的 |
| B.燃料电池系统产生的能量实际上来自于水 |
| C.燃料电池放电时的正极反应: H2-2e-+2OH-=2H2O |
| D.水电解系统中的阳极反应:4OH-―4e-=2H2O+O2↑ |