浓盐酸与重铬酸钾[K2Cr2O7(s)]共热时产生某种气体单质X,产物中还有三氯化铬等生成。这种方法制X时便于控制反应,撤去酒精灯则反应停止。现在要制得纯净的X(装置如图)。
(1)加热时,a与b反应的化学方程式__________________________________
(2)液体C的作用是_____________________________________________
现在把制得的纯净干燥的X通入下图所示的装置。
(3)e是FeBr2溶液,一段时间后观察到的实验现X象是________________________________
(4)f是浸有一种钾盐溶液的棉球,一段时同后观察到试管内有紫色气体,则大试管内发生反应的化学方程式为________________________
(5)g是水和CCl4的混合物,可看到颜色较深的液体在____ (填“上”或“下”)层.
(6)h是碱石灰,则此装置的作用是______________________________________________
铜跟稀硝酸反应,如果有1 mol硝酸被还原了,则被氧化的铜的物质的量为
A.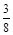 mol mol |
B.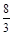 mol mol |
C. mol mol |
D.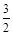 mol mol |
下列实验装置不能达到实验目的的是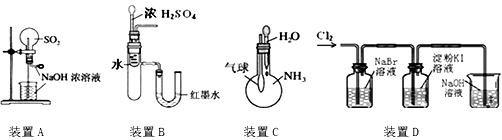
| A.用装置A来做SO2的喷泉实验 |
| B.用装置B来验证浓H2SO4与水混合的热量变化 |
| C.用装置C来验证NH3易溶于水 |
| D.用装置D来验证氧化性:Cl2>Br2>I2 |
四种主族元素的离子a X2+,bY+,cZ-和dR2-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,,对下列叙述的判断正确的是
①c-b=2②元素的原子序数a>b>c>d
③元素非金属性Z>R④最高价氧化物对应水化物碱性X>Y
| A.②③正确 | B.只有③正确 | C.①②③④正确 | D.①②③正确 |
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是
| A.化合物YZ3极易溶解于水 |
| B.Z与M可以形成共价化合物 |
| C.12 g 14X中含有质子的物质的量为6 mol |
| D.由上述四种元素组成的离子化合物受热易分解 |
短周期元素R、T、Q、W在元素周期表中的相对位置如右图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
| A.最高价氧化物对应水化物的酸性:Q<W |
| B.最简单气态氢化物的热稳定性:R>Q |
| C.含T的盐中,T元素只能存在于阳离子中 |
| D.原子半径:T>Q>R |