某化学课外活动小组研究乙醇氧化的实验并验证其产物,并从“乙醇催化氧化实验”得到一些认识有关催化剂的催化机理等问题。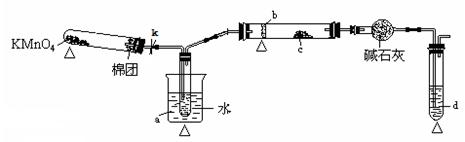
 (1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
(1)甲同学其实验操作为:预先使棉花团浸透乙醇,并按下图搭好实验装置;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
请回答以下问题:
①被加热的铜丝处发生的反应的化学方程式为________。
②从A管中可观察到 实验现象。
(2)乙同学研究乙醇氧化的实验并验证其产物,组合一套实验装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
①若要保证此实验有较高的效率,还需补充的仪器有___________。
理由____________。
②实验中能验证乙醇氧化产物的实验现象是__________________________。
③装置中,若撤去高锰酸钾加热部分并用夹子夹K,其它操作不变,则无水硫酸铜无明显变化,其余现象与②相同,推断燃烧管中主要反应的化学方程式______________________________。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题: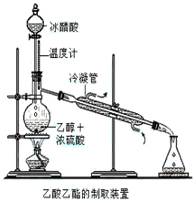
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,
还应放入几块碎瓷片,其目的_____________。
(2)配制乙醇和浓硫酸的混合液的方法是:先在烧瓶中加入一定量的,然后慢慢将加入烧瓶,边加边振荡。
(3)在该实验中,若用1 mol乙醇和1 mol 乙酸在浓硫
作用下加热,充分反应,不能生成1 mol乙酸乙酯的原因是
。
(4)锥形瓶中得到乙酸、乙醇和水的乙酸乙酯的混合物,欲得到乙酸乙酯并闻到它的气味,需将混合液先用溶液处理,再用
(填一种仪器名称)分离。
(5)葡萄糖是生命现象中的一种能量物质。现取少量葡萄糖溶液于试管中,加入新制的Cu(OH)2悬浊液,加热煮沸后现象是,说明分子中含有的官能团是,反应的化学方程式是:
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。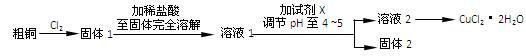
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固 体1(部分仪器和夹持装置已略去)。
体1(部分仪器和夹持装置已略去)。
①仪器A的名称是。
②装置B中发生反应的离子方程式是。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)。
④ NaOH溶液的作用
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
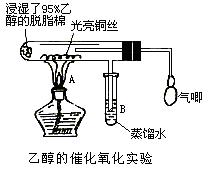
下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。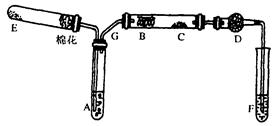
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1) E处是一种纯净物,其发生反应的化学方程式为___ _____。
(2)为使A中乙醇平稳汽化成乙醇蒸气,常采用的方法是_______ ______。
D处使用碱石灰的作用是__ _____。
(3)能证明乙醇反应后产物的实验现象是
。
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同。推断B处发生反应的化学方程式____。
用图示装置制取少量乙酸乙酯(酒精灯、铁架台等在图中均已略去),请填空: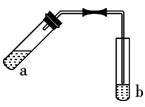
(1)写出试管a中发生反应的化学方程式
(2)某同学在实验过程中,试管a中忘记加入碎瓷片就加热进行实验,为防止暴沸,下一步的操作是:。
(3)实验中加热试管a的目的是:
①:
②:
(4)反应结束后,振荡试管b静置,观察到的现象是
。
23.(10分)下表是某超市出售的加碘食盐的有关说明:
| 精制盐、碘酸钾 |
|
| 含碘量 |
45±5mg/kg |
| 储藏方法 |
通风、防潮 |
| 食用方法 |
根据烹调所需适量加入 |
某研究性学习小组欲通过实验检验该碘盐中是否含碘:
(1)首先取该食盐样品配制室温下的饱和溶液:向200 mL蒸馏水中加入75.0g该食盐样品,加热并搅拌,直到完全溶解。冷却至室温。(已知室温条件下氯化钠溶解度为36 g)
在加热过程中需要用到的仪器有铁架台、酒精灯、铁圈、____________、烧杯和玻璃棒。冷却至室温过程中若出现____________________(填现象),则证明其为饱和溶液。
(2)甲同学先向该饱和食盐溶液中加入1mol/L的KI溶液和几滴淀粉溶液,然后加入0.1mol/L稀硫酸,振荡,溶液变为蓝色。该实验发生的化学反应中氧化剂与还原剂的物质的量之比为_______________。请在下图中画出参加反应的IO3—的物质的量和析出的I2单质的物质的量的关系曲线。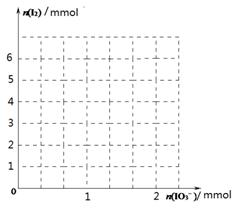
(3)乙同学认为甲同学的实验方案不严谨,他提出如下假设:空气中的氧气可能参与反应,使溶液变蓝。反应的离子方程式为:_____________________________________。
请你设计实验方案验证乙同学的假设是否正确:
。