将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应
2A(g)+B(g)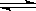 2C(g);△H<0 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是
2C(g);△H<0 4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 ,下列说法中正确的是
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4s 内用物质B表示的反应速率为0.075 mol·L-1·S-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是
| A.a mL | B.(50―a)mL | C.大于(50―a)mL | D.大于a mL |
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是 
| A.甲、乙两烧杯中溶液的pH均保持不变 |
| B.甲烧杯中a的电极反应式为:4OH—―4e—=O2↑+2H2O |
| C.当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 |
| D.当b极增重3.2g时,d极产生的气体为2.24L(标准状况) |
按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量。下列叙述正确的是 
| A.F表示反应生成Cu的物质的量 |
| B.E表示反应消耗H2O的物质的量 |
| C.E表示反应生成O2的物质的量 |
| D.F表示反应生成H2SO4的物质的量 |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是()
A、 若溶液中c(A-)=c(Na+),则溶液一定呈中性
B、 溶液中不可能存在:c(Na+)> c(A-)> c(H+)> c(OH-)
C、 若c(OH-)> c(H+),溶液中不可能存在:c(Na+)> c(OH-)> c(A-)> c(H+)
D、 若溶质为NaA、HA,则一定存在:c(A-)> c(Na+)> c(H+)> c(OH-)
如下图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:t1时刻断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,t2时刻断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是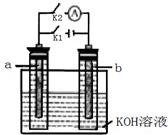
| A.t1时刻开始断开K2,闭合K1一段时间,溶液的pH要变大 |
| B.t2时刻断开K1,闭合K2时,b极上的电极反应式为:2H++2e—= H2↑ |
| C.t1时刻断开K2,闭合K1时,a极上的电极反应式为:4OH—―4e—=O2↑ +2H2O |
| D.t2时刻断开K1,闭合K2时,OH-向b极移动 |