有机物L的分子式为C3H6O2,水解后得到一元酸M和一元醇N,已知M和N的相对分子质量相同,则下列叙述中不正确的是
| A.M具有还原性 | B.M中没有甲基 |
| C.M中H元素的质量分数40% | D.L具有还原性 |
下列各组离子在给定条件下能大量共存的是()
| A.在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
| B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
| C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| D.在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32- |
下列化学反应的离子方程式正确的是()
| A.在稀氨水中通入过量CO2:NH3·H2O+CO2NH4++HCO3- |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-CaSO3↓+2HClO |
| C.用稀HNO3溶解FeS固体:FeS+2H+Fe2++H2S↑ |
| D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-CaSO4↓+H2O |
下列说法中正确的是( )
| A.胶体中分散质粒子直径小于1×10-9 m |
| B.区别胶体与溶液的最简单的方法是丁达尔效应 |
| C.往NaOH溶液中滴入FeCl3溶液立即可制得胶体 |
| D.清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线反射形成的 |
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=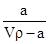 ×100% ×100% |
B.溶质的物质的量浓度c=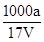 mol/L mol/L |
C.溶液中c(OH-)=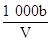 mol/L mol/L |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
下列实验操作会导致实验结果偏低的是()
①配制100 g 10%的CuSO4溶液,称取10 g CuSO4晶体溶于90 g水中 ②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮 ③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g ④用酸式滴定管量取98%、密度为1.84 g/cm3的浓H2SO4配制200 mL 2 mol/L的稀H2SO4时,先平视后仰视
| A.只有① | B.只有② | C.②③④ | D.①③④ |