下列对实验现象的预测或解释正确的是
| A.向品红溶液中通入某无色气体,品红溶液退色,则该气体一定是二氧化硫 |
| B.向血红色的硫氰化铁溶液中通入碘化氢气体,溶液不退色 |
| C.向含酚酞的红色氢氧化钠溶液中通入无色的臭氧气体,红色可能退去 |
| D.向碘化银的悬浊液中加入少量氯化银,并用力振荡,黄色变浅 |
12.已知短周期元素的离子,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A.原子半径 A>B>D>C | B.原子序数d>c>b>a |
| C.离子半径 C3->D->B+>A2+ | D.单质的电负性 A>B>D>C |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为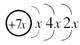 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为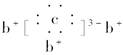 。下列说法中正确的是( )
。下列说法中正确的是( )
| A.原子半径:a>c>d>b | B.电负性:a>b>d>c |
| C.原子序数:d>a>c>b | D.最高价含氧酸的酸性:c>d>a |
元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有()






A.能与水反应
B.能与氢氧化钠反应
C.能与硫酸反应
D.不能与碳酸钠反应
某元素的各级电离能(kJ·mol-1)分别为740、1 500、7 700、10 500、13 600、18 000、21 700,当它与氯气反应时最可能形成的阳离子是( )
| A.X+ | B.X2+ | C.X3+ | D.X4+ |
已知X、Y元素同周期,且非金属性X>Y,下列说法错误的是()
| A.X与Y形成化合物时,X显负价,Y显正价 |
| B.第一电离能Y一定小于X |
| C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| D.气态氢化物的稳定性:HmY小于HmX |