A、B、C、D、E五种短周期元素,原子序数依次递增,A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,而E在同周期元素中原子半径最小。A、C、D三种元素可形成化合物甲,B、C、D三种元素可形成化合物乙,甲和乙均为中学化学常见物质。请回答:
(1)甲的电子式为 ,其中所含化学键类型为 。
(2)A的单质与C的单质在碱性条件下构成燃料电池,其正极反应式为 ;负极反应式 为。
(3)常温下,甲与乙的水溶液pH均为9,这两种溶液中由水电离出的OH—的物质的量浓度c(OH—)甲:c(OH—)乙= .
(4)A与C、D与C可形成化合物A2C、A2C2、D2C、D2C2,说出的一种用途 ;
写出A2C2与E的单质反应的化学方程式 。
(5)浓氨水与固体甲混合,可用于快速制取少量氨气,其原因是
(请用必要的方程式和简要的文字加以说明)。
短周期元素A、B、C在周期表中所处的位置如表所示。A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍。则下列说法正确的是
A.元素D形成的气态氢化物的分子构型一定是正四面体
B.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.在DB2、BC6、DC4的分子中,每个原子都满足8电子稳定结构
D.四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高
下列有关实验的说法正确的是
| A.用pH试纸蘸取NaOH溶液,立刻与比色卡对比,测定NaOH溶液的Ph |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.均不能采取将溶液直接蒸干的方法制得AIC13、A12(SO4)3、FeC13、Fe2(SO4)3 |
| D.滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗 |
N、O、Si、S是重要的非金属元素,下列说法正确的是
| A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱 |
| B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质 |
| C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应 |
| D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2 |
如图是四种常见有机物的比例模型示意图。有关下列说法正确的是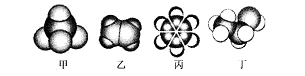
| A.甲能使酸性KMnO4溶液褪色 |
| B.乙可与溴水发生取代反应而使溴水褪色 |
| C.丙与浓硫酸、浓硝酸的混合液共热发生取代反应 |
| D.丁在稀硫酸作用下可与乙酸发生取代反应 |
设NA为阿伏伽德罗常数的值,下列说法中正确的是
| A.常温常压下,11.2L的NO2和CO2混合气体含有NA个O原子 |
| B.标准状况下,22.4L的乙烯中含有的共用电子对数为12NA |
| C.1L0.1mo1·L-1的氨水中含有0.1NA个OH- |
| D.以石墨为电极电解氯化铜溶液时,若阳极上失去电子NA个,则阴极质量增加32g |