早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔) =4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。下列有关说法正确的是d
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是d
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
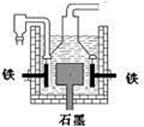
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
下列叙述正确的是( )
| A. |
24g镁与27g铝中,含有相同的质子数 |
B. |
同等质量的氧气和臭氧中,电子数相同 |
| C. |
1mol重水与1mol水中,中子数比为2∶1 |
D. |
1mol乙烷和1 mol乙烯中,化学键数相同 |
化学与生活密切相关。下列说法错误的是( )
| A. |
泡沫灭火器可用于一般的起火,也适用于电器起火 |
B. |
疫苗一般应冷藏存放,以避免蛋白质变性 |
| C. |
家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 |
D. |
电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 |
下列实验过程可以达到实验目的的是( )
|
编号 |
实验目的 |
实验过程 |
|
A |
配制 的溶液 |
称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 |
|
B |
探究维生素C的还原性 |
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
|
C |
制取并纯化氢气 |
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和 溶液 |
|
D |
探究浓度对反应速率的影响 |
向2支盛有5mL不同浓度 溶液的试管中同时加入2mL5% 溶液,观察实验现象 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
我国科学家研发了一种室温下"可呼吸"的
二次电池,将
溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:
 ,下列说法错误的是()
,下列说法错误的是()

| A. |
放电时, 向负极移动 |
B. |
充电时释放 ,放电时吸收 |
| C. |
放电时,正极反应为: |
D. |
充电时,正极反应为 |
代表阿伏伽德罗常数的值,下列说法正确的是()
| A. |
常温常压下, 中所含P-P键数目为 |
B. |
溶液中所含 的数目为 |
| C. |
标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为 |
D. |
密闭容器中, 和 催化反应后分子总数为 |