设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA |
| B.常温下,1 molO2和O3的混合气体中所含氧原子数为2.5NA |
| C.标准状况下,11.2 L的乙烯中含有的共用电子对数为NA |
| D.13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA |
已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
| CH3COOH |
HClO |
H2CO3 |
| Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.4×10-7 Ka2=4.7×10-11 |

A.相同浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O=2HClO+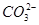
C.图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图像中a点酸的总浓度大于b点酸的总浓度
下列说法错误的是
| A.使用如图所示装置验证Ka(CH3COOH)>Ka(H2CO3)>Ka(H2SiO3) |
| B.0.1 mol·L-1的醋酸中加入水或加入冰醋酸均可使平衡向电离方向移动 |
| C.等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 |
| D.等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少 |
下列说法正确的是
A.0.1 mol·L-1的醋酸溶液加水稀释,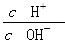 减小 减小 |
| B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(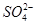 )
)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
下列有关说法中正确的是
| A.常温下,将1 L pH=12的氨水加水稀释为10 L后溶液的pH=11 |
| B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲) |
C.向浓度均为0.1 mol·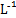 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 |