下列离子方程式正确的是
A.用两个铜电极电解稀盐酸:2H+ + 2Cl- H2↑ + Cl2↑ H2↑ + Cl2↑ |
| B.向Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀AlO2- +HCO3- +H2O = Al(OH)3↓ + CO2 |
| D.向Na2FeO4溶液中加入稀硫酸,迅速反应产生Fe2(SO4)3: |
4FeO42-+20 H+=4Fe3++3O2↑+10H2O
下列关于有机物结构、性质的说法正确的是
| A.石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 |
| B.乙烯和苯都能与氢气发生加成反应,说明二者分子中所含碳碳键相同 |
| C.甲烷、苯、乙醇、乙酸乙酯在一定条件下都能发生取代反应 |
| D.蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |
下列化学用语使用正确的是
A.离子结构示意图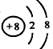 :可以表示16O2-,也可以表示18O2- :可以表示16O2-,也可以表示18O2- |
B.比例模型  :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 |
C.氯化铵的电子式为: |
D.CO2的结构式为: |
将11.9克由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7克。另取等质量的合金溶于过量的稀硝酸中,标准状况下生成了6.72LNO,向反应后的溶液中加入过量的NaOH溶液,则最终所得沉淀的质量为
| A.19.4g | B.22.lg | C.27.2g | D.30g |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 |
X产生氢气的体积比Y多(同温同压) |
金属性:X>Y |
| B |
向滴有甲基橙的AgNO3溶液中滴加KCl溶液 |
溶液由红色变为黄色 |
KCl溶液具有碱性 |
| C |
在CuSO4溶液中加入KI溶液,再加入苯,振荡 |
有白色沉淀生成,苯层呈紫色 |
白色沉淀可能为CuI |
| D |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为
| A.5:4 | B.4:5 | C.5:12 | D.12:5 |