用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是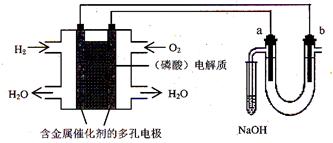
| A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH- |
| B.忽略能量损耗,当电池中消耗0.02g H2 时,a 极周围会产生0.02g H2 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- |
久置空气中会发生颜色变化,但颜色变化不是由于跟氧气反应引起的是
| A.过氧化钠固体 | B.苯酚晶体 |
| C.硫酸亚铁晶体 | D.亚硫酸钠固体 |
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见下图,下列说法完全正确的是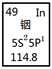
| A.铟元素的质量数是114.8 |
| B.铟元素的相对原子质量是114 |
| C.铟元素是一种主族元素 |
| D.铟原子最外层有3个能量相同的电子 |
下列物质分类正确的是
A. 芳香族化合物 芳香族化合物 |
B. 羧酸 羧酸 |
C. 醛 醛 |
D. 酚 酚 |
化学与生活密切相关,下列说法正确的是
| A.二氧化硫可广泛用于食品的漂白 |
| B.煤经过气化和液化等物理变化可以转化为清洁燃料 |
| C.淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
| D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |