用下图装置测定水中氢、氧元素的质量比,方法是分别测定通氢气前后玻璃管的质量差
和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,不正确的是
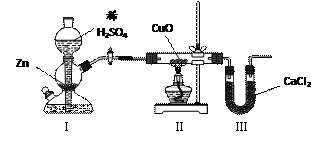
| A.Ⅰ、Ⅱ装置之间缺少干燥装置 | B.Ⅱ装置中玻璃管内有水冷凝 |
| C.Ⅱ装置中CuO没有全部被还原 | D.Ⅲ装置后缺少干燥装置 |
设NA为阿伏加德罗常数,下列说法正确的是()
| A.1mol Cl2通入水中,充分反应后转移电子数为NA |
| B.常温下,1.12L NO2气体含分子数为0.05NA |
| C.1L 0.5mol·L-1碳酸氢钠溶液中含离子数为NA |
| D.通常状况下16gO2和O3混合气体中含氧原子数为NA |
下列装置不能达到相应实验目的的是()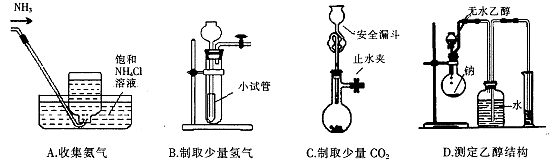
有科学家预测,氨能有望取代氢能,成为重要的新一代绿色能源。下列有关说法不正确的是()
| A.液氨作为清洁能源的反应原理是4NH3+5O2=4NO+6H2O |
| B.液氨具有腐蚀性和毒性,在使用过程中要防止氨泄漏 |
| C.氨气比空气轻,标准状况下密度约为0.76g·L-1 |
| D.氨与氢气相比,优点在于氨不容易发生爆炸,使用时更安全 |
下列符合化学实验“绿色化”的有()
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②在铜和浓硝酸反应的实验中,将铜片改为可调节高度的铜丝
③将实验室的废酸液和废碱液中和后再排放
| A.①② | B.①③ | C.②③ | D.①②③ |
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ()
A.海水 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水 MgCl2溶液 MgCl2溶液 MgCl2熔融 MgCl2熔融 Mg Mg |
C.海水 Mg(OH)2 Mg(OH)2 MgO MgO Mg Mg |
D.海水 Mg(OH)2 Mg(OH)2 MgCl2溶液 MgCl2溶液  MgCl2熔融 MgCl2熔融 Mg Mg |