下列说法中正确的是
| A.有单质参加或有单质生成的化学反应不一定是氧化还原反应 |
| B.有化学键断裂或有化学键形成的变化一定是化学变化 |
| C.若A元素的金属性强于B元素的金属性,则A一定可置换B盐溶液中的B |
| D.弱酸不可能制得强酸,弱酸盐也不可能制得强酸盐 |
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是()
| A.K2Cr2O7可以还原乙醇,故可用来鉴别司机是否酒后驾驶 |
| B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被氧化为六价铬 |
| C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性 |
| D.1mol Cr2O72-得到6mol电子时,还原产物是Cr3+ |
氧化还原反应实际上包含氧化和还原两个过程:①向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O – 2e-→ SO42-+ 4H+;②向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-,在①和②反应中均会生成产物X,则X的化学式为()
| A.NaClO | B.HClO | C.ClO2 | D.NaClO4 |
元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+与Z-具有相同的核外电子层结构。下列推测不正确的是()
| A.同周期元素中X的金属性最强 |
| B.原子半径X>Y,离子半径X+>Z- |
| C.同族元素中Z的氢化物稳定性最高 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是()
A.A、C两元素处在元素周期表中的第ⅥA族
B.C、D两种元素的最高价氧化物的水化物相互能够反应生成一种强电解质
C.B、D两元素组成的化合物中阴、阳离子的个数比为1∶1
D.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
下表列举的各组事实中存在因果关系的是()
| 选项 |
陈述Ⅰ(原因) |
陈述Ⅱ(结果) |
| A |
O3能吸收紫外线 |
大气层中的O3被称为地球保护伞 |
| B |
钠原子核外电子数比铝少 |
钠的金属性比铝强 |
| C |
氯的非金属性比碘强 |
酸性:氢碘酸强于盐酸 |
| D |
N2+3H2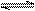 2NH3是放热反应 2NH3是放热反应 |
工业合成氨的反应在高温下进行 |