某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应
A(g)+xB(g) 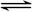 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确是
| A.30min时降低温度,40min时升高温度 |
| B.8min前A的平均反应速率为0.08mol/(L·min) |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.20min~40min间该反应的平衡常数均为4 |
容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,其瓶上一定标有下列六项中的哪几项: ①温度 ②浓度 ③规格(容量) ④压强 ⑤刻度线 ⑥材质
| A.②④⑥ | B.③⑤⑥ | C.①②④ | D.①③⑤ |
下列溶液中,氯离子浓度最大的是
| A.100 mL 1mol∙L‒1的NaCl溶液 | B.150 mL 1mol∙L‒1的MgCl2溶液 |
| C.200 mL 1mol∙L‒1的HCl溶液 | D.10 mL 1mol∙L‒1的AlCl3溶液 |
关于氯水的叙述正确的是
| A.新制氯水可使红色石蕊试纸先变蓝后褪色 | B. 氯水中只含氯分子 氯水中只含氯分子 |
| C.光照氯水有气泡产生,该气体是Cl2 | D.氯水放置数 天后,几乎无漂白性 天后,几乎无漂白性 |
下列选项中,与氯气用途无关的是
| A.消毒杀菌 | B.制漂白粉 | C.制盐酸 | D.从海水中提取食盐 |
下列关于化学反应类型的叙述中,正确的是
A.凡是生成盐和水的反应都 是中和反应 是中和反应 |
| B.复分解反应一定没有单质参加 |
| C.生成一种单质和一种化合物的反应一定是置换反应 |
| D.分解反应的生成物中一定有单质生成 |