(12 分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为 。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为 。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 (填序号)。
二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等领域也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳。
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用双线桥法表示该反应的电子转移总数
Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积 (V)的关系如图所示
(V)的关系如图所示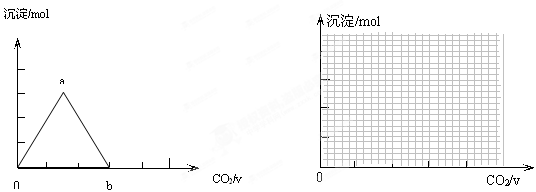
写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系;
并写出与上图中不同曲线处对应的离子反应方程 式;
式;
。

已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
⑴化合物F的化学式为__________,化合物I的化学式为_____________,氧化物A的晶体类型为_____________。
⑵反应①的化学方程式为___________________________________。
⑶氧化物A与烧碱溶液反应的离子方程式为___________________________________。
三氟化氮是一种无色、无味、无毒且不可燃的气体,可在铜的催化作用下由F2和过量NH3反应得到,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3,请根据要求回答下列问题:
⑴写出制备NF3的化学反应方程式:。反应过程中,氧化剂与还原剂的物质的量之比为。
⑵写出三氟化氮与水蒸气反应的化学方程式:。
⑶NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是。
⑷一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染。其产物除H2O外,还有另三种钠盐:
(填化学式)。
⑴24 mL 0.05 mol·L-1的Na2SO3溶液恰好被20 mL 0.02 mol·L-1的K2R2O7溶液氧化,则元素R在还原产物中的化合价是________。
⑵将0.64 g Cu全部溶于一定量的浓硝酸中,测得生成气体0.009 mol(含NO、NO2和N2O4),共消耗硝酸0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。计算空气中参加反应的O2在标准状况下的体积为________mL。
已知:化合物B、C、E中含有两种相同的元素,A可用于玻璃、洗涤剂等的生产,B可用于制作光纤,G的组成元素与D相同。这些化合物之间存在下图所示的转化关系。
请回答:
(1)在化合物A、C、F中含有的 相同元素。
相同元素。
(2)化合物C的化学式为,其水溶液的pH7(填“>”或“<”) 。
。
(3) 700 ℃时,向容积为 2 L的密闭容器中充入一定量的G(g)和H2O(g),发生反应:
2 L的密闭容器中充入一定量的G(g)和H2O(g),发生反应:
G(g)+H2O(g)  D(g)+H2(g)。反应过程中测定的部分数据见下表(表中t1>t2):
D(g)+H2(g)。反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(G)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
① 反应在t1min内的平均速率为v(H2)=mol/(L·min)
② 保持其他条件不变,起始时向容器中充入0.60 mol G和1.20 mol H2O,到达平衡时,
n(D)=mol。
③ 温度升至800℃,上述反应平衡常数为0.64,则正反应为反应(填“放热”或“吸热”)。