A.B.C.D.E是中学化学常见单质,构成它们的元素的原子序数分别为α、b. c.d.е;且3 (a+b) =" 2" (a+c) =" 3" (d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成D单质的元素在周期表中位于 周期 族。
(2)反应③的离子方程式为 E的氧化物与D在一定条件下反应的化学方程式为: 。
(3)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断
N为 型晶体。
(4)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为 。
如图A 为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: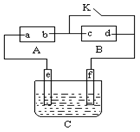
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为______________________;
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d
两点短路,则电极e上发生的反应为________________,
电极f上发生的反应为______________________,槽中放的电镀液可以是__________(填一种电解质溶液即可)。
(10分)A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。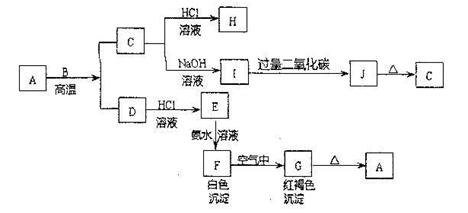
(1)写出下列物质的化学式:
AJ
(2)按要求写方程式:
①C转化为I的离子方程式:。
②F在空气中转化为G的化学方程式:。
③D可以与水蒸气在高温条件下反应,写出此反应的化学方程式:。
Ⅰ.(1)0.02 mol·L-1的HCN溶液与0.02 mol·L-1 NaCN溶液等体积混合,已知该混合溶液中c (Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -)c(H +) ② c(HCN)c(CN-)
(2)常温下,向Al2(SO4)3溶液中滴入Ba(OH)2溶液至Al3+ 刚好完全沉淀时,溶液pH7,(填“>、<、=”)反应的离子方程式为_____________________________。
Ⅱ.依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量FeSO4样品,配成100 mL待测溶液;
②取一定体积待测液置于锥形瓶中,并加入一定量的硫酸;
③将标准浓度的KMnO4溶液装入滴定管中,调节液面至a mL处;
④滴定待测液至滴定终点时,滴定管的液面读数b mL;
⑤重复滴定2~3次。
(1)如何知道滴定到达终点?_
下列操作会导致测定结果偏低的是___________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(2)下列每种量器的数量不限,在上述实验中,必须使用的有;
A.托盘天平 B.量筒 C.碱式滴定管 D.酸式滴定管
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A_________ B _________ C _________(填化学符号)
(2)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:________________________ ___________________________
(3)A离子的氧化性比B离子的氧化性_______(填“强”或“弱”),这是由于_____________.
已知:下列两个热化学方程式:
Fe(s) + 1/2O2(g)  FeO(s)
FeO(s)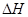 =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)
Al2O3(s) 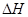 =-1675.7KJ/mol
=-1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是______________________________________________________ 。