实验室有一瓶久置的白色粉末,元素分析证明它由钾、硫、氧三种元素组成,钾和硫的质量比为39∶16,下列结论正确的是
| A.根据元素分析结果推测该粉末为纯净物 |
| B.将粉末溶于水,加入氯化钡,观察到有白色沉淀生成,证明原粉末是硫酸钾 |
| C.将粉末加入盐酸中,产生气泡,证明原粉末是亚硫酸钾 |
| D.将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡生成,原粉末可能是硫酸钾和亚硫酸钾的混合物 |
有机物 A 的分子式为C3H6O2,水解后得到一元酸 M 和一元醇N, 已知M、N的相对分子质量相等,则下列叙中正确的是()
| A.M中没有甲基 | B.N能发生银镜反应 |
| C.M中含碳40% | D.N分子中没有甲基 |
在同温同压下,某有机物和过量Na反应得到V1 L氢气,另取一份等质量的该有机物和足量的NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则该有机物可能是()
| A.HOOC-COOH | B.HOCH2COOH |
| C.HOOCCH(OH)CH(OH)COOH | D.CH2OHCH2OH |
下列叙述正确的是( )
| A.正戊烷分子中的最多有5个原子在同一平面上 |
B.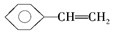 分子中最多有8个碳原子在同一平面上 分子中最多有8个碳原子在同一平面上 |
| C.CH2="CH-CH=" CH2中所有原子可能在同一平面上 |
| D.2-丁烯(CH3CH=CHCH3)分子中4个碳原子可能在同一直线上 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)为放热反应,400℃ 30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g)为放热反应,400℃ 30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
| A.点a的逆反应速率比点b的大 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
下列关于有机化合物的说法正确的是( )
| A.CH3CH(CH3)CH3和CH(CH3)3是两种不同的物质 |
| B.由乙烯之间的相互加成可以得到聚乙烯 |
| C.丁烷有3种同分异构体 |
| D.1mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |