下列实验操作正确的是
| A.检验某溶液中是否含有甲醛:在盛有2mL10%硫酸铜溶液的试管中,滴加4~8滴10%的氢氧化钠溶液,混合均匀,滴入待检液,加热 |
| B.实验室制乙烯:将浓硫酸与无水乙醇按体积比3∶1混合后迅速加热至170℃ |
| C.制取溴苯:将铁屑、液溴、苯充分混合后加热 |
| D.提取溶解在水中的少量碘:加入植物油振荡、静置、分层后取出有机层再分离 |
现有两种烯烃CH2=CHCH3和 ,它们混合在一起,在一定条件下进行加聚反应,其中产物可能有(
,它们混合在一起,在一定条件下进行加聚反应,其中产物可能有( )
)
| A.③⑤⑦ | B.①②③④ | C.①②③⑤⑥ | D.全部 |
某有机物的分子式为C1 0H14O2Cl2,分子结构中不含有环和碳碳三键,只含有一个,则该分子中含有碳碳双键的数目为()
0H14O2Cl2,分子结构中不含有环和碳碳三键,只含有一个,则该分子中含有碳碳双键的数目为()
| A.1个 | B.2个 | C.3个 | D.4个 |
已知 ①丙烷②正丁烷③异丁烷④2-甲基丁烷⑤己烷,上述物质的沸点按由低到高的顺序排列的是()
①丙烷②正丁烷③异丁烷④2-甲基丁烷⑤己烷,上述物质的沸点按由低到高的顺序排列的是()
| A.①③②④⑤ | B.⑤④③②① | C.①②③④⑤ | D.⑤①②④③ |
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是()
| A.利用金属钠或者金属钾 | B.利用红外光谱法 |
| C.利用质谱法 | D.利用核磁共振氢谱 |
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为()
| A.(a+3b)mol | B.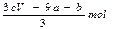 |
C.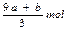 |
D.(cV-3a-9b)mol |