在一密闭容器中充人4 mol SO2和一定量O2,发生反应:
 2SO2(g)+O2(g)2SO3(g)△H=一196.6 kJ·mol-1。
2SO2(g)+O2(g)2SO3(g)△H=一196.6 kJ·mol-1。
则下列说法正确的是 ( )
| A.为提高反应速率和SO2的转化率选择更高效的催化剂 |
| B.增大压强有利于SO2转化,平衡常数也会增大 |
| C.当放出353.6 kJ热量时,SO2的转化率接近90% |
| D.右图中纵坐标y为SO3的含量 |
有研究发现,奥司他韦可以有效治疗H1N1流感,奥司他韦分子式为C16H28N2O4·H3PO4,分子结构如图,是一种纳米级药物,下列有关奥司他韦的说法中正确的是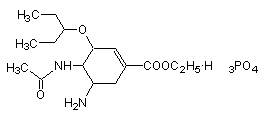
| A.只含极性键,易溶于水,其水溶液有丁达尔效应 |
| B.分子中只含有酯基、氨基、肽键三种官能团 |
| C.1mol 该物质最多能与4molNaOH反应 |
| D.可以发生加成、取代、氧化反应 |
下列溶液中微粒的物质的量关系正确的是
| A.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4) |
| B.①0.2mol/LNH4Cl溶液、②0.1mol/L (NH4)2 Fe(SO4)2溶液、③0.2mol/LNH4HSO4溶液 ④0.1mol/L(NH4)2 CO3溶液中,c(NH4+)大小:③>②>①>④ |
| C.0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合: c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
| D.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-) |
下列装置所示的实验中,能达到实验目的的是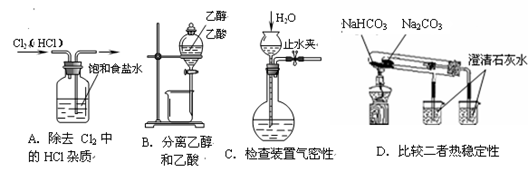
盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
| A.酒精的燃烧热为Q3 kJ |
| B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ |
| C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化 |
| D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
关于阿伏加德罗常数(用NA表示)的下列叙述完全正确的是
| A.1mol羟基(—OH)与17gNH3所含电子数都为NA |
| B.12.4g白磷(分子式为P4)中含有P-P共价键0.4 NA |
| C.由铜锌硫酸原电池中,当Cu极生成2.24LH2,则电路通过电子一定为0.2NA |
| D.将足量的铜屑加入到浓度均为2mol·L-1的HNO3和H2SO4的混合溶液100mL中,充分反应后,转移的电子数为0.45NA |