C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。若将2.00 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是( )
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物中Cu的质量为1 2.8 g |
| C.反应后的固体混合物总质量为14.4 g |
| D.反应后的固体混合物中氧化物的物质的量为0.05mol |
某酯完全燃烧生成等摩的CO2和H2O,把该酯水解可得羧酸 B和醇C,把醇C氧化可得羧酸D,且B与D互为同分异构体,则此酯为 ( )
| A.CH3CH2COOCH(CH3)2 |
| B.CH3CH2COOCH2CH2CH=CH2 |
| C.(CH3)2CHCOOCH2CH(CH3)2 |
| D.CH3CH2CH2COOCH2CH(CH3)2 |
乙酸苯甲酯的结构简式如图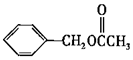 ,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种 ( )
,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种 ( )
| A.3 | B.4 | C.5 | D.6 |
某一种有机物的结构为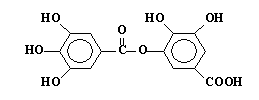 ,关于它的性质的叙述中不正确
,关于它的性质的叙述中不正确
的是 ( )
| A.它可以水解,水解产物只有一种 |
| B.1mol该有机物最多能和8molNaOH反应 |
| C.1mol该有机物最多能和4molBr2发生反应 |
| D.1mol该有机物最多能和8molH2发生加成反应 |
下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧时耗O2的量不变的是
| A.甲烷、甲醇、甲醛 |
| B.乙炔、苯、1,3-丁二烯 |
| C.丙烯、2-丁烯、环已烷 |
| D.乙醇、乙烯、丙烯酸(CH2=CH-COOH) |
某饱和一元醛和酮(RCOR')的混和物共0.5mol,质量为26.2g,该混和物与足量银氨溶液作
用,最多析出43.2g银。则混和物中的醛可能是 ( )
| A.乙醛 | B.丁醛 | C.戊醛 | D.已醛 |