短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个未成对电子
(1)若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C三种元素的单质熔点由大到小的顺序是 (用化学式表示)。
(3)当n=2时,B位于元素周期表的 区,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
请根据官能团的不同对下列有机物进行分类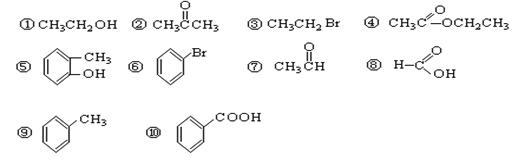
(1)芳香烃: ;(2)卤代烃:;
(3)醇: ;(4)酚: ;(5)醛: ;
(6)酮: ;(7)羧酸: ;(8)酯:。
(Ⅱ)
⑴键线式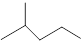 表示的分子式。
表示的分子式。
⑵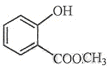 中含有的官能团的名称为。
中含有的官能团的名称为。
⑶书写该物质的名称: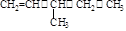
今有分子量为58的几种有机物,试推断符合条件的有机物的分子式或结构简式
(1)若该有机物为烃,则分子式为,其中带有支链的同分异构体在核磁共振氢谱图中有个吸收峰
(2)若该有机物是一种饱和一元脂肪醛,则其与新制氢氧化铜悬浊液在加热条件下反应的化学方程式为。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则其结构简式为。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则其结构简式为,(注羟基连在双键上的有机物极不稳定)该物质生成高分子化合物的化学方程式为。
选用适当的试剂和方法除去下列物质中的杂质(括号内)填下表:
除杂质的试剂:①氢氧化钠溶液②溴水③生石灰④饱和碳酸钠溶液
除杂质的方法:A分液 B萃取 C蒸馏 D过滤
| 混合物 |
除杂质的试剂 |
除杂质的方法 |
| 苯(苯酚) |
(1) |
(4) |
| 酒精(水) |
(2) |
(5) |
| 乙酸乙酯(乙酸) |
(3) |
(6) |
(1)按系统命名法,有机物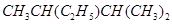 的名称是 。若该有机物是由烯烃加成氢气得来的,那么烯烃的结构有种,若该有机物是由炔烃加成氢气得来的,那么炔烃的结构简式该炔烃与含等物质的量的溴的四氯化碳反应的方程式为
的名称是 。若该有机物是由烯烃加成氢气得来的,那么烯烃的结构有种,若该有机物是由炔烃加成氢气得来的,那么炔烃的结构简式该炔烃与含等物质的量的溴的四氯化碳反应的方程式为
(2)支链只有一个乙基且式量最小的烷烃 的结构简式
氯化钠样品含有少量的Na2SO4和 Na2CO3,按下列流程进行净化,请在流程中的()中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第步②
第步③
第步⑤