仔细分析下列表格中烃的排列规律,判断排列在第12位的烃的分子式是( )
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
| C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
| A.C6H12 | B.C6H14 | C.C5H12 | D.C5H10 |
X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,存在下图所示的转化关系,则以下判断正确的是()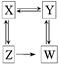
| A.X是羧酸,Y是酯 | B.Z是醛,W是羧酸 |
| C.Y是醛,W是醇 | D.X是醇,Z是酯 |
下面有关晶体的叙述中,不正确的是( )
| A.金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
有一种脂肪醇,通过一系列反应可变为丙三醇,这种脂肪醇通过消去、氧化、酯化、加聚反应等变化后可转化为一种高聚物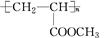 ,这种醇的结构简式可能为()
,这种醇的结构简式可能为()
| A.CH2=CHCH2OH | B.CH2ClCHClCH2OH |
| C.CH3CH2OH | D.CH3CH(OH)CH2OH |
下列关于σ键和π键的理解不正确的是()
| A.σ键能单独形成,而π键一定不能单独形成 |
| B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C.HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D.气体单质中一定存在σ键,可能存在π键 |
金属原子在二维空间里的放置有如图所示的两种方式,下列说法中正确的是()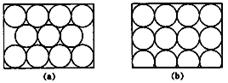
| A.图a为非密置层,配位数为6 |
| B.图b为密置层,配位数为4 |
| C.图a在三堆空间里堆积可得六方最密堆积和面心立方最密堆积 |
| D.图b在三维空间里堆积仅得简单立方堆积 |