在右图所示的三个容积相同的容器①②③中均发生如下反应:
3A(g)+B(g)  2C(g) ;△H<0
2C(g) ;△H<0
下列说法正确的是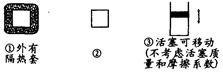
A.若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为③>②>①
B.若维持温度不变,起始时②中投入3 mol A、1 mol B;③中投入3 mol A,1 mol B和2molC,则达到平衡时,两容器中B的转化率②=③
C.若起始温度相同,分别向三个容器中充入1 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量一定相同
D.若起始温度相同,分别向三个容器中充入3a mol A和a mol B,则达到平衡时各容器中A物质的转化率一定相同
控制适合的条件,将反应 设计成如图所示的原电池。下列判断不正确的是
设计成如图所示的原电池。下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.电流计读数为零后,在甲中溶入FeCl2固体, 乙中石墨电极为负极 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.反应开始时,甲中石墨电极上Fe3+被还原 |
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
下列说法正确的是
| A.在相同条件下随着卤素原子核电荷数的增加,平衡时X2的转化率逐渐降低 |
| B.t2>t1,HX的生成反应是吸热反应 |
| C.随着卤素原子核电荷数的增加HX的还原性逐渐减弱 |
| D.随着卤素原子核电荷数的增加HX的稳定性逐渐增强 |
下列对各组离子或物质是否能够大量共存解释正确的是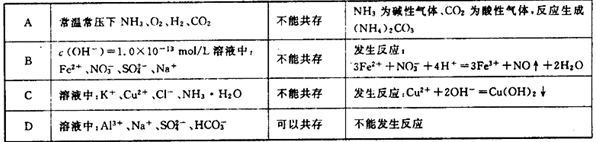
在1 100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) △H=akJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g) △H=akJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是
| A.达到化学平衡状态时,若c (CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L |
| B.若要提高CO的转化率,则应该加入适当的过量FeO |
| C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D.若生成56 g Fe.则吸收的热量小于a kJ |
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。下列说法正确的是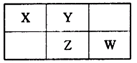
| A.元素Z位于周期表中第二周期,VA族 |
| B.W元素最高价氧化物的水化物酸性是同周期最强的 |
| C.这些元素中,Y的氢化物水溶液碱性最强 |
| D.四种元素中原子半径最大的为W |