某温度下,在一容积不变的密闭容器中,A(g)+2B(g)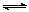 3C(g)达到平衡时,A、B、C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向为
3C(g)达到平衡时,A、B、C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向为
A.向左移动 B.向右移动 C.不移动 D.无法判断
等物质的量浓度的下列溶液中,c(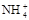 )最大的是()
)最大的是()
| A.NH4HCO3 | B.NH4NO3 | C.(NH4)2CO3 | D.NH4HSO4 |
向0.1 mol/L的氨水溶液中加水稀释或加入少量NH4Cl固体时均会引起变化的是()
| A.溶液的导电能力减弱 | B.溶液的pH变小 |
| C.NH3·H2O的电离度变大 | D.Kw(水的离子积常数)变大 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是()
A.在0.1 mol/L NaHCO3溶液中:c(Na+) ﹥c(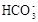 ) ﹥ c( ) ﹥ c(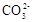 ) ﹥ c(H2CO3) ) ﹥ c(H2CO3) |
B.在0.1 mol/L Na2CO3溶液中:c(OH-) – c(H+) = c(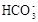 ) + c(H2CO3) ) + c(H2CO3) |
| C.向0.2 mol/L NaHCO3溶液中加入等体积0.1 mol/L NaOH溶液: c( 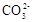 ) ﹥ c( ) ﹥ c(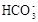 ) ﹥ c(OH-) ﹥ c(H+) ) ﹥ c(OH-) ﹥ c(H+) |
| D.向 0.1 mol/L的CH3COONa溶液中加入等体积0.1 mol/L CH3COOH溶液: |
2c(H+) – c(CH3COO-) = 2c(OH-) – c(CH3COOH)
有①Na2SO3溶液②CH3COOH溶液③HCl溶液各25 mL,物质的量浓度均为0.1 mol/L。下列说法正确的是()
| A.三种溶液的pH的大小顺序是①﹥②﹥③ |
| B.三种溶液稀释相同倍数,pH变化最大的是① |
| C.三种溶液中含微粒种类多少顺序是:②﹥①﹥③ |
| D.三种溶液中由水电离出c(H+)大小顺序是:③﹥②﹥① |
将浓度为0.1 mol/L Na2CO3溶液加水稀释,下列结论错误的是()
| A.水解平衡正向移动 | B.各微粒浓度均变小(除H2O外) |
| C.溶液中离子数目增多 | D.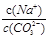 比值增大 比值增大 |