关于小苏打水溶液的表述正确的是( )
| A.c (Na+)="c" (HCO3-) + c (CO32-) + 2c (H2CO3) |
| B.c (Na+) + c (H+) =" c" (HCO3-) + 2c (CO32-) +c (OH-) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
D.存在的电离有:NaHCO3 Na++HCO3—,HCO3— Na++HCO3—,HCO3— H++CO32—,H2O H++CO32—,H2O  H++OH— H++OH— |
下列叙述中错误的是
| A.葡萄糖和果糖互为同分异构体 | B.淀粉、油脂、蛋白质均能发生水解反应 |
| C.乙醇可使酸性高锰酸钾溶液褪色 | D.苯和溴水在FeBr3的条件下可制得溴苯 |
下列物质既含有离子键又含有极性键和非极性键的是
| A.KOH | B.H2O2 | C.CH3COONa | D.NH4Cl |
下列实验的实验目的、图示操作和实验现象均正确的是
| A. 探究不同催化剂对同一反应速率的影响 |
B. 探究温度对化学平衡的影响 |
 试剂:淀粉溶液、碘水、 唾液、2mol/L H2SO4溶液 现象:图中左试管溶液颜色一段时间后逐渐变蓝色,右试管溶液颜色迅速变蓝色 |
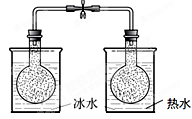 2NO2(g)  N2O4 △H<0 N2O4 △H<0试剂:烧瓶中各充入等质量的NO2 现象:一段时间后,右边烧瓶内气体颜色变浅,左边烧瓶内气体颜色变深 |
| C. 探究醋酸、碳酸、硼酸的酸性强弱 |
D. 验证外加电流的阴极保护法 |
 试剂:0.1 mol/L醋酸溶液、饱和硼酸溶液 0.1 mol/LNa2CO3溶液 现象:图中左试管内液面产生气泡,右试管无明显现象 |
 试剂:酸化的3%的NaCl溶液、 铁氰化钾溶液 现象:一段时间后,向烧杯中滴加2滴铁氰化钾溶液,不产生蓝色沉淀 |
下列现象不能用沉淀溶解平衡移动原理解释的是
| A.相同温度下,AgCl在水中的溶解度大于在氯化钠溶液中的溶解度 |
| B.浓FeCl3溶液滴入沸水加热形成红褐色透明液体 |
| C.自然界地表层原生铜矿变成CuSO4溶液向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS) |
| D.加入少量AgCl固体可以除去氯化钠溶液中的少量硫化钠杂质 |
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是
A. 稀释前两溶液中H+浓度的大小关系:A=10B
B. 稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L
C. 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同
D. 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7