下列说法正确的是
| A.同一短周期元素的离子半径从左到右依次减小 |
B. 和 和 互为同分异构体 互为同分异构体 |
| C.熔沸点:邻二甲苯 > 间二甲苯 > 对二甲苯 |
| D.第VA族的非金属元素的氢化物中,沸点最高的也最稳定 |
下列叙述中正确的是
| A.虽然Cu能导电,但Cu是非电解质 |
| B.BaSO4虽然难溶于水,但BaSO4是电解质 |
| C.SO3溶于水能导电,所以SO3是电解质 |
| D.NaNO3溶液能导电,故NaNO3溶液是电解质 |
试管中盛有少量白色晶体,可能是铵盐,检验的方法是
| A.加水,将湿润的红色石蕊试纸放在试管口 |
| B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| C.加氢氧化钠溶液,加热,滴入酚酞 |
| D.加氢氧化钠溶液,加热,滴入紫色石蕊试剂 |
在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3 S↓+2NO2↑+2H2O S↓+2NO2↑+2H2O |
B.CuO+2HNO3 Cu(NO3)2+H2O Cu(NO3)2+H2O |
C.4HNO3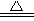 4NO2↑+O2↑+2H2O 4NO2↑+O2↑+2H2O |
D.3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O 3Cu(NO3)2+2NO↑+4H2O |
下列对硝酸的认识不正确的是
| A.打开浓硝酸的瓶盖会冒白雾 | B.锌跟稀硝酸的反应是置换反应 |
| C.常用硝酸来制炸药、化肥等 | D.稀硝酸也是一种强氧化性酸 |
用铜锌合金制成的假金元宝骗人的事件屡有发生,下列不易区别其真伪的方法是
| A.测定密度 | B.放入硝酸中 | C.放入盐酸中 | D.观察外观 |