下列叙述中不正确的是
| A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B.硫酸的酸性比磷酸的酸性强,所以硫的非金属性比磷强 |
| C.氟化氢是最稳定的气态氢化物 |
| D.氢氧化铝的碱性强于氢氧化镁的碱性 |
下图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是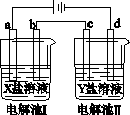
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
Pb(NO3)2 |
| C. |
FeSO4 |
Al2 (SO4)3 |
| D. |
CuSO4 |
AgNO3 |
某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
| A.正极反应为AgCl+e-===Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
工业上常用Fe作电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2 2 2 |
D.甲中阳极附近溶液中的离子反应方程式是: +6Fe2++14H+ +6Fe2++14H+ 2Cr3++6Fe3++7H2O 2Cr3++6Fe3++7H2O |
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则
A.电流方向:电极Ⅳ→  → 电极Ⅰ → 电极Ⅰ |
| B.电极Ⅰ发生还原反应 |
| C.电极Ⅱ逐渐溶解 |
| D.电极Ⅲ的电极反应:Cu2++2e-===Cu |
用惰性电极电解饱和食盐水,当电源提供给0.2 mol电子时停止通电。若此溶液体积为2L,则所得电解液的pH是
| A.1 | B.8 | C.13 | D.14 |