根据以下3个热化学方程式
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1) △H=—Q1kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(1) △H=—Q2kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=—Q3kJ·mol-1
对Q1、Q2、Q3三者大小关系的判断正确的是( )
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是()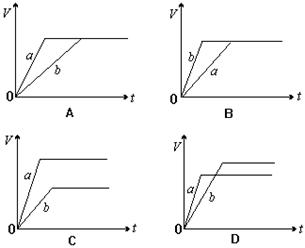
在一个密闭的容器中发生如下反应,2SO2(g)+O2(g) 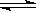 2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度均为0.2 mol·L-1,当达到平衡时可能的数据是()
2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度均为0.2 mol·L-1,当达到平衡时可能的数据是()
| A.c(SO3)="0.4" mol·L-1 | B.c(SO3)= c(SO2)="0.15" mol·L-1 |
| C.c(SO2)="0.25" mol·L-1 | D.c(O2)="0.3" mol·L-1 |
在一容积可变的密闭容器中,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.化学计量数关系a>b |
一定条件下,某反应的化学方程式为:CO2+NO  NO2+CO ,下列说法正确的是()
NO2+CO ,下列说法正确的是()
| A.升高温度,正反应速率增大,逆反应速率减少 |
| B.恒温时,压缩容器的体积,颜色加深,因平衡左移 |
C.达到平衡,其平衡常数为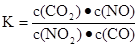 |
| D.恒容时,升高温度,混合气体的颜色加深,该反应的焓变为正值 |
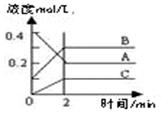
右图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是()
A.A是反应物
B.前2 min A的分解速率为0. 1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A (g)  2 B(g) + C(g)
2 B(g) + C(g)