已知H2(g)+I2(g) 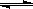 2HI(g)
2HI(g) 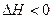 有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的
有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的 平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
| A.甲、乙提高相同温度 | B.甲中加入0.1mol He,乙不改变 |
| C.甲降低温度,乙不变 | D.甲增加0.1mol H2,乙增加0.1mol I2 |
下列描述,其因果关系成立的是
| A.因为NH3的水溶液可以导电,所以NH3是电解质 |
| B.因为O2可以与CO反应生成CO2,所以可以用O2除去CO2中的杂质CO |
| C.因为液态HCl不导电,所以HCl是非电解质 |
| D.因为氢氧化铁胶体具有吸附性,所以常用于净水 |
下列实验操作中不正确的是
| A.用容量瓶配制一定物质的量浓度的NaOH溶液时,溶解后的溶液要马上转移至容量瓶 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
下列对于某些离子的检验说法中正确的是
| A.加入硝酸银产生白色沉淀,一定有Ag+ |
| B.某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+ |
| C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
| D.可用焰色反应实验检验溶液中是否含有K+ |
鉴别NaOH、Na2CO3、Ba(OH)2三种溶液,最好选用下列试剂中的
| A.石蕊溶液 | B.稀盐酸 | C.稀硫酸 | D.CaCl2溶液 |
 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中 I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关 I的叙述中错误的是
I的叙述中错误的是
A. I的化学性质与 I的化学性质与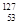 I相同 I相同 |
B. I的原子序数为53 I的原子序数为53 |
C. I的原子核外电子数为78 I的原子核外电子数为78 |
D. I的原子核内中子数多于质子数 I的原子核内中子数多于质子数 |