在相同温度下,等体积、等物质的量浓度的下列溶液①Na2SO4、②H2SO3、③NaHSO3、④Na2S中,所含带电微粒数由多到少的顺序为( )
| A.④>①>③>② | B.①>④>③>② |
| C.①=④>②=③ | D.④=①>③>② |
下列说法正确的是()。
| A.含有H+离子的溶液一定呈酸性 |
| B.0.1 mol/L KOH溶液和0.1 mol/L氨水中,其c(OH-)相等 |
| C.pH为1的盐酸的c(H+)是pH为3的盐酸的100倍 |
| D.Na2 CO3溶液中,c(Na+)是c(CO32-)的两倍 |
在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)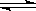 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
| A.容器内压强不随时间变化 | B.容器内密度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1︰2︰2 | |
| D.单位时间消耗0.1 mol X同时生成0.2 mol Z |
中和相同体积、相同pH的硫酸、盐酸和醋酸三种稀溶液,所用相同浓度的NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系为( )
| A.V3>V2>V1 | B.V3=V2>V1 |
| C.V3>V2=V1 | D.V1=V2>V3 |
工业氧化二氧化硫制三氧化硫反应的化学方程式为:2SO2(g)+ O2 (g)  2SO3(g)△H=—198kJ·mol-1假设这个反应处于平衡状态,在体积不变的条件下,下列措施会使化学平衡逆向移动的是
2SO3(g)△H=—198kJ·mol-1假设这个反应处于平衡状态,在体积不变的条件下,下列措施会使化学平衡逆向移动的是
| A.增加二氧化硫 | B.升高温度 | C.降低温度 | D.移出三氧化硫 |
已知0.1 mol/L的醋酸溶液中存在电离平衡: CH3COOH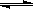 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是( )。
| A.加少量CH3COONH4固体 | B.降低温度 | C.加少量NaOH固体 | D.加水稀释 |