在75℃左右,用HgSO4作催化剂,乙炔可水化为乙醛.但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种.现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如图: 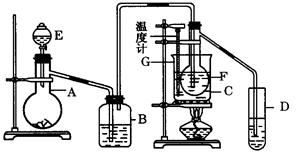
请回答以下问题:
(1) 实验开始时,仪器A中盛放电石,B中应装入 ,其作用是 .
(2) 仪器D中盛放水,其作用是 .
(3) 蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先
后顺序写出包括HgO在内的各试剂名称 ,将HgO加入F中的操作方法是 .
(4) 装置图中,加热F的方式叫 ,所选用温度计G的量程表示正确的是__________(填代号).
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ | D.0℃~360℃ |
(5) 检验乙醛已制出的操作、现象是 .
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。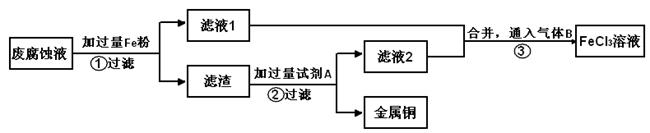
学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+ = Mn2++ Fe3++ H2O。下列说法正确的是
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Mn2+的还原性强于Fe2+ |
| C.离子方程式中按物质顺序的化学计量数是:1、5、8、1、5、4 |
| D.生成1 mol 水时,转移2.5 mol电子 |
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的 CO2后,再稀释到100mL。
(1)在 NaOH 溶液中通入一定量的 CO2后,溶液中溶质的可能组成是①NaHCO3 ②Na2CO3 ③NaOH、Na2CO3 ④______________。
(2)在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示:
①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是 mL(标准状况)。
②原NaOH溶液的物质的量浓度为_________。
现有十种物质:①铁单质 ②石墨 ③氯气 ④硫酸钡晶体 ⑤纯硫酸 ⑥盐酸 ⑦澄清石灰水 ⑧乙醇 ⑨熔化的硝酸钾 ⑩FeCl2溶液
(1)其中能导电的是 ,属于电解质的是 。
(2)请写出下列反应的离子方程式:
①与⑥反应: 。
③与⑦反应: 。
(3)H2O2能与酸性FeCl2溶液反应,请配平其化学方程式,标出电子转移的方向和数目。
HCl+ H2O2+ FeCl2= FeCl3+ H2O
其中被还原的元素是 ,氧化产物是 ,当生成9g的水时,反应转移 mol电子。